 病因
病因
病因:感染是导致小儿肝硬化的主要病因,先天性胆道梗阻及先天性代谢缺陷和遗传病也为小儿肝硬化较常见的病因:
1.感染 病毒性肝炎(乙型肝炎、
丙型肝炎、丁型肝炎、庚型肝炎、巨细胞病毒性肝炎)、风疹病毒、单纯疱疹病毒、水痘病毒;
先天性梅毒;寄生虫病(日本血吸虫、肝吸虫、
弓形体病)等。
2.先天性遗传代谢异常 肝豆状核变性(Wilsons disease),肝糖原累积症(Ⅳ型),
半乳糖血症,α
1抗胰蛋白酶缺乏症,先天性酪氨酸血症(congenital tyrosinosis),遗传性果糖不耐受症,范可尼综合征(Fanconi syndrome),
胰腺囊性纤维性变(mucoviscidosis),β-脂蛋白缺乏症(βlipoproteinemia),遗传性出血性毛细血管扩张症(Osler-Weber病),血色素沉着症(hemochromatosis)[特发性遗传性血色病(IHC),新生儿血色病(NHC),继发性血色病],过氧化物酶体病(peroxisomal disorders,PD)[脑-肝-
肾综合征(又称Zellwegar综合征), 胆管发育不良伴三羟粪甾烷酸血症(biliary hypoplasia with trihydroxy coprostanic acidemia,THCA)。
3.后天性代谢异常 乙醇中毒,营养性,中毒性(新生儿感染中毒、毒素、药物)。
4.免疫异常 自家免疫性肝炎(AIH),原发性胆汁性
肝硬化(PBC),小儿原发性硬化性胆管炎(PSC)。
5.肝及胆管囊性疾病(cystic diseases of the biliary tract and liver)
 发病机制
发病机制
发病机制:
1.发病机制
(1)感染:因病毒、细菌、真菌及寄生虫等感染肝脏后,渐进展为
肝硬化,儿童中常见为乙型或
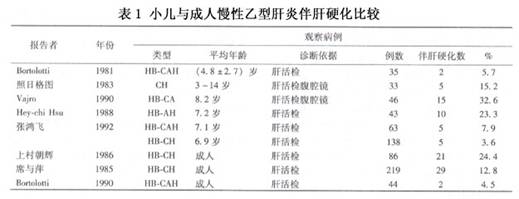
丙型病毒性肝炎(表1);急性重症肝炎后坏死后性
肝硬化;新生儿因免疫功能不完善,感染肝炎后呈亚临床过程,易发展成慢性肝炎或
肝硬化;巨细胞病毒、风疹病毒、单纯疱疹病毒宫内感染,
先天梅毒均易侵犯肝脏,发展为慢性肝炎、
肝硬化;寄生虫病中晚期血吸虫病、华支睾吸虫病、
弓形虫病及
疟疾;细菌中毒性肝炎较少发展为
肝硬化,但金黄色葡萄球菌
败血症或1岁以下婴儿伴有营养不良或病毒性肝炎时易导致
肝硬化。
(2)遗传性或先天性代谢缺陷:主要由于某些酶的缺陷使酯、氨基酸、脂肪或金属微量元素铜、铁等贮积肝脏,致
肝硬化。常见有肝豆状核变性、α
1抗胰蛋白酶缺乏症、酪氨酸血症、
半乳糖血症、
糖原累积病Ⅳ型、遗传性果糖不耐受症、Fanconi综合征、戈谢病等;含铁血黄素沉着症和血色沉着症(hemachromatosis)的后期进展为
肝硬化,但较罕见;Zellweger综合征(脑肝肾综合征)是少见的常染色体隐性遗传病,为过氧化物酶体(peroxisome)发育缺陷或过氧化物酶体中某一种酶功能缺失所致,以
肝硬化、肾囊肿、肌无力、惊厥、特殊面容及青光眼、白内障等先天眼疾为主要表现,伴有铁代谢异常。
(3)毒物及药物中毒:如砷、磷、铋、氯仿、异烟肼、辛可芬、毒蕈等中毒。
(4)免疫异常:法国学者Vajro等对92例小儿慢性肝炎进行了前瞻性研究,其中乙型肝炎和自身免疫性肝炎各46例,前者32%发展为
肝硬化,而后者为89%。可见在法国儿童的肝炎后
肝硬化中,自身免疫性肝炎占病因学首位。
(5)肝及胆管囊性疾病:为一组
先天性肝纤维化和胆管囊性病变疾病。
先天性肝纤维化(CHF)为常染色体隐性遗传病,病因不详,约40%为同胞儿,解放军302医院收治过同胞兄妹为CHF,确诊主要靠肝活检。Caroli病遗传方式同CHF,确诊靠B超、CT,必要时内镜下逆行胆、胰管造影(ERCP)。
先天性胆总管囊肿详见胆道疾病。
(7)其他原因:未能确定病因者并不少见。印度儿童
肝硬化主要发生于印度及其邻近地区,西非及中美洲地区亦有报告,多于1~3岁发病,
肝肿大为最初表现,其他尚有发热、厌食及
黄疸,多数迅速进展为
肝硬化、肝功能衰竭。此病发生原因不清。
2.病理变化
肝硬化的特点是结缔组织增生。较多肝细胞或肝小叶的肝细胞变性、坏死后。纤维组织增生取代正常肝组织,若病变累及邻近数个小叶则小叶结构紊乱,支架塌陷。由于纤维组织的收缩及再生结节的挤压,使肝内血流障碍,可致门脉高压,病变继续进行,形成侧支循环。一般分为门脉性、坏死后性及胆汁性
肝硬化三型,晚期常为混合型。
(1)门脉性
肝硬化(portal
cirrhosis):小儿较成人少,由于慢性肝炎或肝充血,早期肝脏多肿大,后期缩小,质坚硬,表面不规则呈颗粒或结节状。组织学可见肝细胞变性或坏死,肝小叶正常结构破坏,有大小不等的再生结节,结节周围及汇管区纤维组织增生,分布较广泛。纤维组织间可见不同程度的炎性细胞浸润和胆小管增生。肝血管网被压、移位。
(2)坏死后性
肝硬化(post necrotic
cirrhosis):多发生于急性重症肝炎或中毒性肝炎后数月。肝脏缩小,质变硬,肝实质多呈大块坏死,累及一个或数个小叶,网状支架塌陷,结缔组织增生,呈较宽的纤维束。邻近坏死区的肝细胞再生,形成结节,大小不一。较大的结节内常存在有正常的肝小叶。纤维组织中炎性细胞浸润及胆管增生较明显。
(3)胆汁性
肝硬化(biliary
cirrhosis):在小儿多为继发性,其病理变化主要为明显的肝细胞及小胆管内胆汁淤积。组织学见汇管区结缔组织增生,其中可有新生胆管及炎性细胞浸润。肝内小胆管扩张,有胆汁淤积及胆栓形成。增生的结缔组织在小叶间及小叶内生长,肝细胞无明显再生。
 临床表现
临床表现
临床表现:
肝硬化临床症状悬殊,代偿期可仅有食欲不佳、恶心、呕吐、
腹胀、
腹泻等消化道症状。主要体征为
肝大,脾脏亦可增大。失代偿期临床表现逐渐明显,患儿渐见消瘦、乏力,出现门脉高压、
腹水、
脾功能亢进、有出血倾向。亦可见肝掌、
蜘蛛痣,但婴幼儿时期较少。患儿面色晦暗,常伴有贫血。后期侧支循环形成,有食管下端及胃底静脉曲张,为门脉高压的结果。
2.坏死后性
肝硬化 这类
肝硬化一旦发生,其发展较迅速,不易代偿,常在短期内由继发感染导致肝衰竭而死亡。进展较慢者,可逐渐出现
肝硬化的症状和体征。但多数病儿常以肝衰竭为最早表现,出现
黄疸、消化道症状,易误诊为急性肝炎。北京儿童医院病理科报道14例坏死后
肝硬化病例,自症状出现至死亡多数为2~3个月,最短11天,最长的2例分别为半年及2年3个月。
肝硬化发展的快慢与患儿年龄有直接关系,新生儿及婴儿肝炎发展速度较快,有病理资料证明
新生儿肝炎发展为
肝硬化,多在1~6个月内死亡。
(1)原发性:有特殊的临床表现。多数有发热、乏力、食欲减退及上腹不适。由于毛细胆管炎,早期表现梗阻性
黄疸、皮肤瘙痒、尿色深黄、
腹泻、大便变白色或色浅,肝显著增大。
黄疸持续长期者可能出现出血倾向及皮肤
黄疸。实验室检查主要为阻塞性
黄疸的表现。病程呈良性经过,可达数年,终因
肝硬化、肝衰竭及消化道出血而恶化。本病与肝炎病毒的关系尚未明了。也可能与自身免疫有关。
(2)继发性:在小儿时期,主要为肝外胆道梗阻继发
肝硬化,其临床表现为阻塞性
黄疸,与原发性病例很相似,而预后及治疗则完全不同,因此必须加以鉴别,并避免错误的手术。
 其他辅助检查
其他辅助检查
其他辅助检查:
1.超声检查 虽然B型超声常不能精确测出肝或脾的大小,亦不能对肝的硬度进行诊断,但可对门静脉直径及其扭曲程度进行评估,且有助于检出少量腹水及肾脏结构是否异常。
行多普勒超声检查,在门静脉周围发现有侧支血管形成是肝外门静脉阻塞的一个征象。正常情况下可见到呼吸对门静脉血流有调节作用,如果此征消失提示门静脉高压。但出现此征亦不能绝对排除门静脉高压。
2.食管X线钡剂造影 食管X线钡剂造影检查能显示食管静脉曲张存在与否及其程度。曲张的静脉多位于食管的下2/3,显示钡剂充盈缺损的阴影。如静脉曲张严重且较广泛时则如数条交叉在一起的蚯蚓。静脉曲张的程度与病因或患儿的年龄无关。一般来讲,厚钡剂较薄钡剂显影为佳,但有时必须采用厚、薄两种钡剂使细致的食管黏膜纹路更加清楚地显示出来。
在成人,钡剂造影检出食管静脉曲张的敏感性约为70%。近年来由于内镜的广泛应用,此项技术已很少用于食管静脉曲张的检查,而且对上消化道活动性出血的检出价值极其有限。
3.胃镜检查 胃镜检查可直接观察食管静脉曲张存在与否及其程度。目前,对全部儿科年龄组的病人行内镜检查是可行且安全的、也是证实食管胃底静脉曲张存在的最准确、最敏感的方法。对上消化道出血的患儿,一旦病情平稳,应立即进行胃镜检查,以便尽快确定出血部位、病变性质及迅速行镜下止血治疗。
对无症状或处于稳定期的患儿亦可行胃镜检查以便预测静脉曲张出血的风险及选择预防性硬化治疗的时机。
4.选择性肠系膜上动脉造影 经股动脉插入导管,行选择性肠系膜上动脉造影,正常情况下门静脉在10~20s内即可显影。当门静脉血栓形成时,门静脉不能充盈。在伴有海绵状血管瘤样变异的病人,于闭塞的门静脉周围可见有许多细小的侧支血管形成。可能存在的血管影像还有:门静脉血流逆向流动、食管胃底静脉曲张以及其他部位门体间分流形成。
 治疗
治疗
治疗:对肝硬化应综合治疗,根据病人具体情况采用相应的方法,并应及早治疗导致肝硬化的原发病。
1.支持治疗 注意适当休息,晚期需卧床休息。进食高热量、高糖类、适量蛋白质、多种维生素(尤以B族维生素及A、D、K及C更重要)、易消化而无刺激的食物。选择适当的护肝药物,品种不要过多,尤其避免用对肝脏有毒性的药物,如苯巴比妥、
氯丙嗪、四环素、异烟肼等。代偿功能障碍时可适量使用维生素B
1、
葡萄糖等。肝功能严重受损、全身情况较差者可从静脉补充营养,如给予
葡萄糖加胰岛素、
水解蛋白、氨基酸、
血浆、全血或
人血白蛋白,必要时可采用肠道外营养,并给予
辅酶A、
三磷腺苷(
ATP)等。
2.治疗原发病 病因病原治疗对活动性肝硬化,如病毒性肝炎、自家免疫性肝炎(AIH)等导致肝硬化,在活动性代偿期时应积极做抗病毒等相应病因病原治疗。肝炎活动性病变或进行性肝坏死主要控制其发展并使之静止。可用泼尼松口服,肝炎控制后减量,给予维持。同时给予硫唑嘌呤,或给予免疫增强剂。各种病毒性肝炎、肝硬化进行相应的治疗。原发性胆汁性肝硬化主要对症和支持治疗;继发性胆汁性肝硬化应尽早手术治疗,以解除胆管梗阻,不能手术的原发性胆汁性肝硬化者行支持和对症治疗。
3.中医药治疗 中医认为本病早期气滞血淤、肝脾肿大,属实证,治疗以清化湿热,疏肝化淤法。晚期由于气滞血淤加重,波及脾肾,久而脾肾阳虚,行水无力,水湿停聚,出现腹水,而形成“臌胀”,此期可以虚湿兼见。腹水是标,脾肾阳虚是本,根据病情标、本、缓、急之不同,采取急则治标,缓则治本,或标本兼治之法,随证加减。
4.并发症的治疗
(1)腹水:限钠、限水,钠盐应限制在每天0.5g以下,摄水量限制在每天1L以下。必要时输血、
血浆或
人血白蛋白,并用适当的利尿药。对腹水中蛋白可应用自身再输注法,对大量腹水可用腹水超滤、回输治疗。
有腹水者原则上不宜放腹水,除腹水量大压迫心肺,呼吸困难者,行腹腔穿刺放液时,量不可过多。必要时输全血、
血浆或无钠
白蛋白,并可用利尿药如氢氯噻嗪(双氢
克尿塞)、螺内酯(安体舒通)等。无效时改用呋赛米。但在肝性脑病情况下不宜用利尿药以免引起水、电解质的紊乱。激素对胆汁性肝硬化有一定效果。
(2)消化道出血:除禁食、注射维生素K
1外,可给予
生长抑素(施他宁、
奥曲肽)降低门静脉压,
生长抑素(施他宁),半衰期1~3min,首剂250µg加入5%
葡萄糖溶液10ml静脉缓慢注射,维持量3.5µg/(kg·h),止血后维持48~72h;
奥曲肽(善得定),半衰期90~120min,首剂100µg加入5%
葡萄糖溶液10ml静脉缓慢注射,维持量2.5µg/(kg·h),止血后维持48~72h。大出血时输入全血补充血容量和
血浆白蛋白。脾脏大而肝功能较好者,可行脾切除术。另外,对上消化道出血可行内镜治疗,根据出血血管的情况选择相应的治疗方法,如钳夹、圈套及注射硬化剂等。
(3)肝性脑病:肝性脑病的治疗是综合性、多环节的。
①去除诱因:控制诱因常可有效地制止肝性脑病的发展。例如食管曲张静脉破裂大出血后可发展成肝性脑病,积极止血、纠正贫血、清除肠道积血等可以制止肝性脑病的发生。
②营养支持治疗、改善肝细胞功能:肝性脑病患者往往食欲不振,或已处于昏迷状态,不能进食,仅靠一般的静脉输液远远不能满足机体的需要。
A.饮食:应以碳水化合物为主,禁蛋白质,至少3天。
B.水、电解质和酸碱平衡。
③减少或拮抗氨及其他有害物质,改善脑细胞功能:
A.减少肠道内氨及其他有害物质的生成和吸收:a.导泻或灌肠。b.改变肠道的pH,减少NH3的形成。c.抗生素(青霉素,先锋霉素)。
B.降低血氨、减少和拮抗假性神经递质:a.降血氨药物。b.左旋多巴。c.BCAA。
④其他:有脑水肿时,应予以脱水治疗。此外,肝性脑病患者有低氧血症,应予以吸氧,有报道,高压氧疗法可取得较好的效果。
(4)肝肾综合征:去除肾功能衰竭的诱因,维持出入量平衡,适当合理的扩容疗法,腹水过滤浓缩回输,透析疗法及外科门腔静脉分流术。
5.肝移植(liver transplantation) 人工肝是彻底治疗肝硬化的有效方法,尤其是对代谢性肝病和肝内胆管发育异常所致肝硬化。由于受供者的限制,尚不能大规模地开展。
6.抗肝纤维化治疗 抗肝纤维化药物如秋水仙碱(Colchicine)、青霉胺(Penicillamine)、γ-干扰素及中药制剂,可根据病情选用。



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预防
预防